復宏漢霖發佈2020年度業績:3款產品喜迎收穫,3款產品蓄勢待發,持續豐富創新內涵,站位全球未來可期
2021年3月26日,復宏漢霖(2696.HK)公佈了2020年度業績,就公司近期重要進展和業績成果進行了分享。作為一家國際化的創新生物製藥公司,復宏漢霖致力於為全球病患提供可負擔的高品質生物藥,產品覆蓋腫瘤、自身免疫性疾病、眼科疾病等領域。
2020年,復宏漢霖實現營業收入約人民幣5.876億元,較2019年增長約546%,來自多款產品陸續商業化帶來的銷售收入、向客戶提供的研發服務及授權許可收入。截至目前,公司已成功在中國上市3款產品,在歐盟上市1款產品,2款產品在中國遞交上市註冊申請(NDA)。其中漢曲優®(曲妥珠單抗,歐盟商品名:Zercepac®)作為中國首個自主研發的中歐雙批單抗藥物,開闢了中國企業成功闖關“世界盃”的先河,進一步打通國產單抗藥物的國際化道路。
在全速推進產品全球商業化的同時,復宏漢霖持續加碼創新,2020年研發開支約為人民幣17.109億元,高效推動產品進入臨床開發階段。公司在全球範圍內獲得超過30項臨床試驗許可,在中國、歐盟、澳大利亞、烏克蘭、菲律賓和土耳其等國家和地區同時開展20多項臨床試驗。創新管線先導產品抗PD-1單抗HLX10全面覆蓋了高度微衛星不穩定型實體瘤、肺癌、肝細胞癌、食管鱗癌、頭頸癌和胃癌等主要癌種,且為擁有較多國際臨床數據的PD-1產品之一,有望於2021年3月底/4月初遞交NDA。
復宏漢霖執行董事、首席執行官、總裁張文傑先生表示:
“2020年復宏漢霖以卓越商業化為覈心工作,加速推進管線產品上市行程,持續最大化生物類似藥商業價值。同時,我們不斷加碼創新,協同中美兩地科研中心提高研發效率,打造日趨成熟的差异化創新管線。未來,我們將會秉承‘可負擔的創新,值得信賴的品質’這一覈心理念,通過‘內外兼修’,加速創新研發,提高創新效率,將創新產品研發和全球商業化作為主導覈心,為全球患者帶來更多更好的治療新選擇。”
核心產品一一落地,類似藥收穫喜人
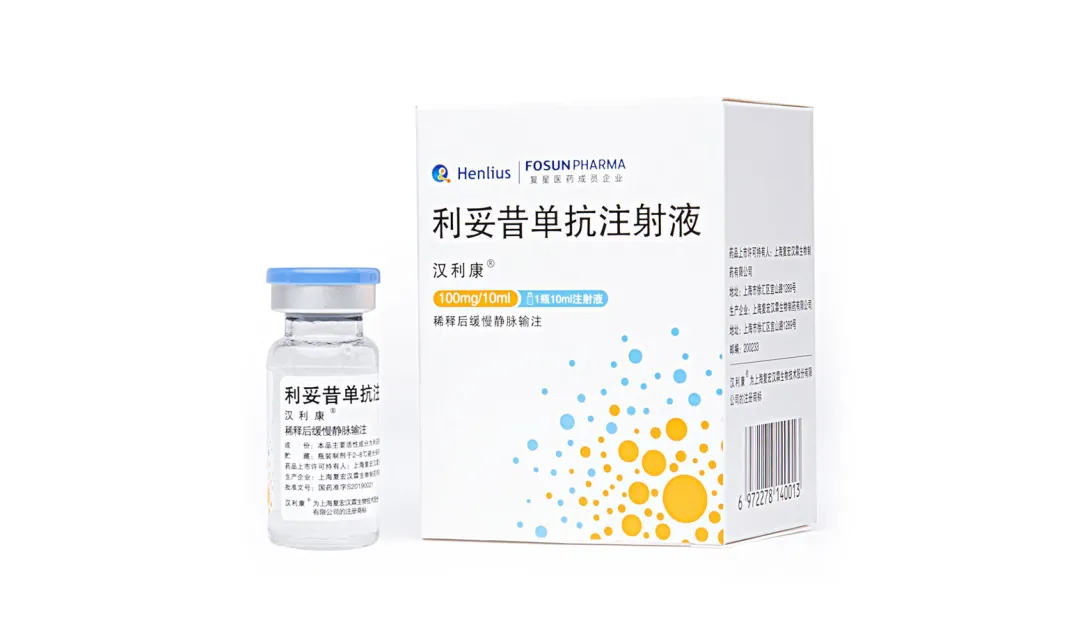
公司首個產品漢利康®(利妥昔單抗)於2019年2月正式獲得中國國家藥監局(NMPA)NDA準予,為中國首個生物類似藥,可用於非霍奇金淋巴瘤和慢性淋巴細胞白血病的治療,其在國內的商業化銷售由復星醫藥旗下公司江蘇復星負責。2020年漢利康®出廠約72萬支,其中下半年約52萬支,公司根據與合作夥伴江蘇復星的利潤分成實現銷售收入約2.882億元,並實現授權許可收入約1040萬元,收入大幅增加。截至2020年末,漢利康®已完成了全國30個省市的醫保開通,並於其中28個省市完成正式掛網/備案採購,在近七成覈心醫院實現進藥。上市兩年以來,漢利康®累計惠及超過3萬名中國患者,其卓越的產品品質、安全有效的臨床表現獲得了醫生、患者以及行業的認可。此外,2020年,漢利康®在注册審批方面也取得重要進展,先後完成了2000昇生產規模的擴容,新增500mg/50ml/瓶產品規格等,並成功外推了兩項新適應症,商業化進入全面加速階段。
漢曲優®(曲妥珠單抗,歐盟商品名:Zercepac®)於2020年7月和8月相繼獲得歐盟委員會與NMPA準予上市,用於HER2陽性乳腺癌和胃癌的治療。2020年漢曲優®在中歐共獲得銷售收入1.36億元。漢曲優®為首款由公司商業化團隊主導在中國境內銷售推廣的產品,獲批後6個工作日內便於多家醫院開出首張處方,截至目前,漢曲優®已開通全國所有省市的醫保准入,於28個省市完成招標掛網,為惠及更多患者打下了堅實基礎。公司計畫於2021年進一步擴充漢曲優®的銷售隊伍並加强銷售網路計畫,並著力夯實HER2陽性患者診療生態圈建設,積極與相關企業展開合作,加快推進產品的市場下沉,“不讓一個HER2陽性患者落下”。現時,漢曲優®新增60mg/瓶的補充申請(sNDA)已獲得NMPA受理,預計可於2021年第三季度獲批上市。

同時,復宏漢霖持續聯合商務合作夥伴Accord積極推進Zercepac®在歐盟的商業化行程,快速實現海外市場的商業化“著陸”。2020年,Zercepac®已在包括德國、西班牙、法國、愛爾蘭、義大利、匈牙利等近20個歐盟國家和地區成功上市,並在英國進入國家醫保和全球多家頂級醫院,包括倫敦的Chelsea Hospital、Westminster and Kings College Hospital等。Zercepac®在歐盟的新增規格60mg/瓶和420mg/瓶也有望於2021年獲批上市,以更多劑型選擇和組合用藥方案惠及更多病患。
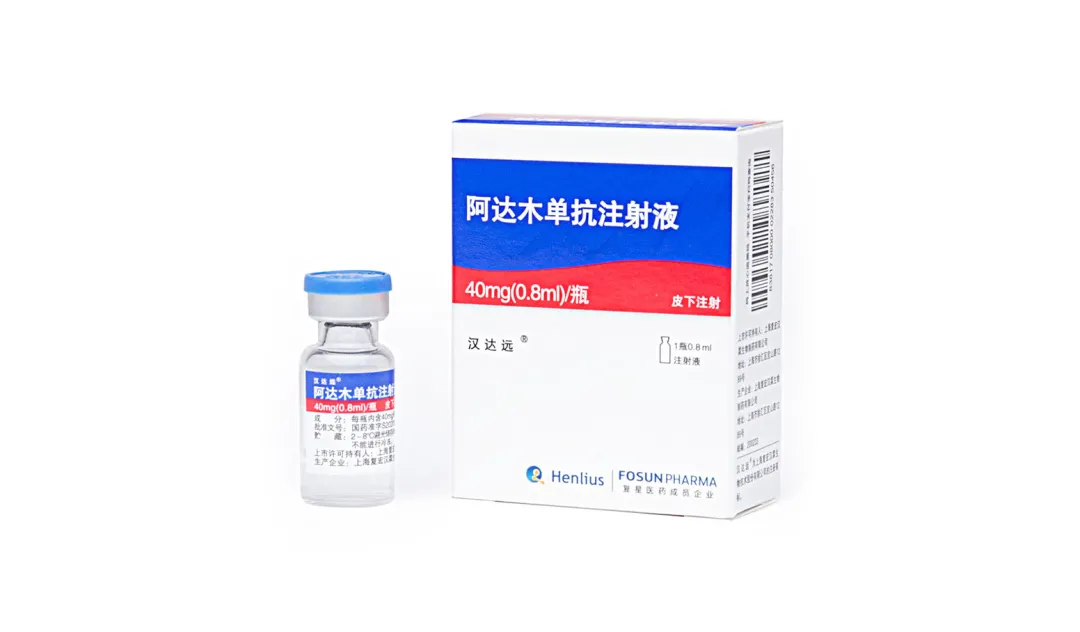
漢達遠®(阿達木單抗)為公司第三款在國內上市的單抗生物藥,也是首款治療自身免疫疾病的產品,於2020年12月獲NMPA準予上市,用於類風濕關節炎、强直性脊柱炎和銀屑病的治療,進一步擴大了公司服務的病患群體。2021年1月,復宏漢霖就漢達遠®向NMPA遞交新增葡萄膜炎適應症的sNDA獲得受理。漢達遠®上市後的國內商業銷售由江蘇萬邦負責,公司基於合作協定獲得銷售利潤分成120萬元。截至目前,漢達遠®已經成功完成22個省市掛網。
多款產品蓄勢待發,商業化後繼有力
在多款生物類似藥逐步商業化的同時,復宏漢霖持續拓展商業化產品管線,以實現業績的高速增長。HLX04(貝伐珠單抗生物類似藥)和HLX01(利妥昔單抗)類風濕關節炎RA新適應症的NDA已分別獲得受理,有望於2021年第四季度和2021年末/2022年上半年在中國獲批上市。
HLX04擬用於結直腸癌、非小細胞肺癌的治療,區別於目前國內已上市的產品,其III期臨床研究選擇了轉移性結直腸癌,是國內現時唯一擁有轉移性結直腸癌臨床數據的貝伐珠單抗生物類似藥,可為貝伐珠單抗在中國結直腸癌患者人群中的應用積累更多臨床數據與經驗。該III期研究數據已在第23届全國臨床腫瘤學大會暨2020年CSCO學術年會上發佈,對HLX04和原研貝伐珠單抗在治療轉移性結直腸癌中的療效、安全性和免疫原性的相似性進行了驗證。為惠及更廣泛的病患群體,公司亦計畫於HLX04上市後啟動原研貝伐珠單抗新增的腦膠質瘤(GBM)適應症的申請。
此外,復宏漢霖對已上市的漢利康®採取了差异化的開發策略,同步開展了原研利妥昔單抗在中國境內尚未獲批的類風濕關節炎適應症的臨床研究。HLX01(利妥昔單抗)具有給藥頻次低、藥物有效性持續時間長等優勢,有望大幅提升患者用藥依從性,有效改善患者生活質量並降低患者醫療負擔。2020年12月,HLX01(利妥昔單抗)RA新適應症的NDA獲得NMPA受理,將成為復宏漢霖自身免疫疾病領域的又一重要產品,豐富公司的產品佈局。
HLX10(抗PD-1單抗)為復宏漢霖自主研發的覈心創新型單抗產品,可聯合其他產品開展免疫聯合療法廣泛用於實體瘤的治療,公司計畫分別於2021年3月底/4月初和2021年下半年向NMPA遞交HLX10單藥治療高度微衛星不穩定型實體瘤和HLX10聯合化療一線治療局部晚期或轉移性鱗狀非小細胞肺癌的NDA。復宏漢霖針對HLX10前瞻性地進行了國際化佈局,相繼於中國、美國、波蘭等歐盟國家獲得臨床試驗準予,並在適應症的選擇和聯合治療上重點發力,就以HLX10為覈心的2項單藥及8項聯合療法同步在全球多個國家和地區同步開展臨床試驗,截至目前已於中國、土耳其、波蘭、烏克蘭、俄羅斯等國家及地區累計入組約2000名患者,為擁有國際臨床數據較多的PD-1產品之一。公司已於2019年與KG Bio達成合作,授權對方在東南亞10個國家就HLX10用於相關療法和適應症的獨家開發和商業化權利,為產品進入國際市場奠定基礎。
產能質量雙雙突破,全平臺保駕護航
為進一步推動公司商業化全面發展,確保產品的高品質生產和穩定供應,2020年,復宏漢霖加快提升和完善大規模生產能力,並通過不斷引入和使用國際前沿的生產科技,有效把控生產成本,提高生產效率。
公司徐匯生產基地及配套的品質管制體系已通過NMPA、歐洲藥品管理局(EMA)、歐盟質量受權人(QP)以及國際商業合作夥伴進行的多項實地核查及稽核,獲得了中國與歐盟GMP認證,為公司產品在中歐市場的成功商業化起到至關重要的作用。
截至2020年末,公司就徐匯生產基地新增4臺2000昇生物反應器完成備案,將公司總體商業化產能提升至20000昇。2020年,徐匯基地亦通過了一系列精實管理、工藝優化舉措,促進生產效率的提升。此外,公司計畫2021年於徐匯基地新增一條預充針生產線,為公司已上市產品短期內的市場需求提供進一步供給。
為進一步完善中長期產能規劃,公司於2020年完成了松江基地(一)建設,該基地已完成全部12臺2000昇生物反應器建設,產能共計24000昇,現時已經開始臨床樣品試生產。計畫用於長期產能建設、規劃占地面積200畝的松江基地(二)一期項目前正在建設過程中,已完成樁基工程以及主要生產樓的結構封頂,及主要生產樓建築主體結構的驗收和主要設備及工程項目的招標等工作,預計將於2021年完工投入試生產並開展相關驗證工作。與此同時,公司將儘快推動松江基地(二)二期項目建設投產,進一步滿足公司生物類似藥、生物創新藥產品的全球商業化生產需求。
在先進生產科技的應用上,公司在松江基地(一)持續推進連續流科技的開發和產業化,於2020年末完成了連續化生產中試車間的建設、調試及驗證工作,該連續化生產中試車間涵蓋上游Perfusion及下游連續生產線,已依託現有項目完成了兩批下游連續生產測試。
攜手全球戰略夥伴,國際化加速推進
作為一家國際化的創新生物製藥公司,復宏漢霖長期以來秉持國際化的戰畧佈局,基於豐富的產品管線,戰略性對外授權產品商業化權利,攜手國際合作夥伴推動全球佈局。2020年,公司通過國際商業化合作,實現授權許可收入1.5億元,包括就漢曲優®從Accord處獲得的授權許可收入及研發服務收入約8560萬元。
2020年3月,復宏漢霖與Mabxience達成合作,授予對方在阿根廷、烏拉圭及巴拉圭針對漢曲優®在腫瘤治療領域的開發及商業化獨家權利。2020年6月,漢曲優®正式獲批前,公司前瞻性佈局該產品在歐洲的商業化市場,通過與Accord合作陞級,新增授權許可規格,以降低患者組織劑量的用藥成本,滿足患者個性化的用藥需求。漢曲優®獲批上市後,復宏漢霖進一步與Accord US達成合作,授予對方在美國和加拿大漢曲優®的獨家開發與商業化權益,成功將漢曲優®的商業化佈局全面拓展至北美生物藥市場。
為惠及更多眼科疾病患者,復宏漢霖積極探索貝伐珠單抗HLX04-O(重組抗VEGF人源化單克隆抗躰注射液)在濕性年齡相關性黃斑變性(wAMD)等眼部疾病中的療效,該適應症病患群體廣泛但用藥尚未普及。公司於2020年與億勝生物達成合作共同開發HLX04-O,並授予對方在全球範圍內針對眼科適應症進行注册開發、生產及商業化的獨家許可權。未來,雙方將圍繞HLX04-O眼科適應症在中國、澳大利亞、歐盟、美國等國家和地區開展國際多中心臨床試驗,並憑藉研究結果在全球多個國家和地區同步進行上市申報。現時,HLX04-O已通過了澳大利亞藥品管理局(TGA)的臨床試驗備案及美國食品藥品監督管理局(FDA)臨床試驗準予,該項目的國際多中心III期臨床研究將於近期啟動。
內外兼修齊頭並進,加速創新未來可期
隨著公司生物類似藥產品陸續上市,復宏漢霖搭建了成熟的全產業鏈一體化平臺,初步兌現了製藥企業商業價值。2020年,公司秉持“內外兼修”的開發策略,協同中美兩地研發中心,强化轉化醫學能力,並同步引入優質外部項目,持續加碼創新,提升研發效率。依託在抗體藥物領域豐厚的科技和資源積累,公司積極拓展新潜力靶點、雙特异性抗體、抗體偶聯藥物(ADC)等產品的佈局,持續推動早期項目儲備,以創新型抗PD-1單抗HLX10為先導,逐步打造出一條覆蓋多個創新靶點的差异化、多元化管線,為公司創新藥研發的推進、卓越商業化目標注入動力,從而真正滿足患者的需求。
2020年,HLX10聯合化療治療鱗狀非小細胞肺癌和廣泛期小細胞肺癌的兩項全球多中心III期臨床研究分別在土耳其完成境外首例患者給藥,前者現時已經完成患者入組。截至目前,HLX10聯合HLX07(抗EGFR單抗)治療復發或轉移性頭頸部鱗狀細胞癌(SCCHN)的II期臨床研究、HLX10聯合HLX04治療轉移性結直腸癌的II/III期臨床研究和創新產品抗c-MET單抗HLX55的I期臨床研究均已經完成首例患者給藥。同時,公司亦同步推動更多創新產品進入臨床開發階段,創新型抗DR4單抗HLX56獲得中國臨床試驗許可,創新型抗LAG3單抗HLX26獲得中國新藥臨床試驗申請受理。
面對新冠疫情的全球蔓延,公司加快投入新冠肺炎預防/治療藥物的研究工作,自主開發的新冠候選藥物HLX71(ACE2-Fc受體融合蛋白)已獲得美國FDA新藥臨床試驗許可,並獲國家重點研發計畫“公共安全風險防控與應急科技裝備”重點專項新冠肺炎應急項目立項支持。公司現時正在進行臨床試驗的籌備工作,計畫加快推動HLX71在美國開展臨床研究,以期為全球疫情貢獻中國力量。
2020年1月,公司通過與日本Chiome公司合作,引入抗TROP2抗體及相關知識產權在中國(包括香港特別行政區、澳門特別行政區和臺灣地區)的研究、開發、生產和商業化的獨家權利。公司將攜手合作夥伴積極探索該產品在ADC、雙特异性抗體、組合療法等方面的開發潛力,充分發揮TROP2靶點在三陰性乳腺癌、非小細胞肺癌、尿路上皮癌等多種實體瘤的廣譜療效,基於臨床需求探索更多創新可能。
2021年,復宏漢霖將繼續向著卓越商業化全面邁進,追求全產品週期的高品質發展,以臨床需求為導向,以創新為本,開發更多療效更好的創新治療方案。
關於復宏漢霖
復宏漢霖(2696.HK)是一家國際化的創新生物製藥公司,致力於為全球患者提供可負擔的高品質生物藥,產品覆蓋腫瘤、自身免疫疾病、眼科疾病等領域,已在中國上市3款產品,在歐盟上市1款產品,2款產品獲得中國上市註冊申請受理。自2010年成立以來,復宏漢霖已建成一體化生物製藥平臺,高效及創新的自主核心能力貫穿研發、生產及商業運營全產業鏈。公司已建立完善高效的全球研發中心,按照國際GMP標準進行生產和質量管控,位於上海徐匯的生產基地已獲得中國和歐盟GMP認證。
復宏漢霖前瞻性佈局了一個多元化、高品質的產品管線,涵蓋20多種創新單克隆抗躰,並全面推進基於自有抗PD-1單抗HLX10的腫瘤免疫聯合療法。繼國內首個生物類似藥漢利康®(利妥昔單抗)、中國首個自主研發的中歐雙批單抗藥物漢曲優®(曲妥珠單抗,歐盟商品名:Zercepac®)、公司首個自身免疫疾病治療產品漢達遠®(阿達木單抗)相繼獲批上市,公司HLX04貝伐珠單抗及HLX01利妥昔單抗類風濕關節炎新適應症的上市註冊申請也正在審評中。公司亦同步就10個產品、8個聯合治療方案在全球範圍內開展20多項臨床試驗,對外授權全面覆蓋歐美主流生物藥市場和眾多新興國家市場。